Le matériel biologique étudié a été sélectionné selon les critères suivants :
1) espèces très communes et abondantes en France ;
2) espèce de papillon de la Famille Lycaenidae ayant un grand nombre d’espèces avec un cycle biologique en relation avec des fourmis (Bellmann, 2006); espèce de fourmis en lien avec le papillon Polyommatus icarus dans son cycle biologique; espèces de plantes hôtes Angiosperme (plante à fleurs), vivaces (pérennes) privilégiées par Polyommatus icarus parmi les légumineuses, Fabaceae, Papilonacées (Bellman, 2006; Lewington & Tolman, 2014 ; Carter & Hargreaves, 2015 ; Martiré et al., 2016 ; Haahtela et al., 2017) ;
3) espèces faciles d’élevage en conditions contrôlées, espèces pouvant se développer dans l’espace disponible du laboratoire, plantes d’une hauteur maximum de 50 cm ;
4) potentiellement sensible au changement climatique ;
5) biologie générale connue.
Les espèces sélectionnées sont donc les suivantes :
- Papillon : Polyommatus icarus,
- Fourmis : Lasius niger,
- Plantes hôtes : Trifolium repens, Lotus corniculatus.

Biologie et écologie du papillon l’Azuré commun Polyommatus icarus (Rottemburg, 1775) (Lepidoptera, Lycaenidae)
Nom latin : Polyommatus icarus (Rottemburg, 1775)
Noms vernaculaires : Azuré commun, Argus bleu, Azuré de la Bugrane ; Common Blue (Anglais)
Taxonomie : Règne : Animalia, Embranchement: Arthropoda, Classe : Insecta, Ordre : Lepidoptera, Famille : Lycaenidae , Genre : Polyommatus, Espèce : Polyommatus icarus
Détermination de l’espèce :
- Détermination de l’imago
Face supérieure des ailes : dimorphisme sexuel marqué; bleu-violet avec une fine bordure noire pour le mâle ; brun à lunules oranges près de la marge sur les ailes antérieures et postérieures pour la femelle (Hofmann, 2007 ; Lewington & Tolman, 2014 ; Martiré et al., 2016)

Face inférieure des ailes : brun clair, points noirs cerclés de blanc, ligne de lunules oranges près de la marge, franges blanches ; aile antérieure à 1 ou 2 points cellulaires ; aile postérieure avec un triangle blanc, ligne postdiscale de points noirs régulière (Lewington & Tolman, 2014 ; Martiré et al., 2016)

Envergure : 2,7 cm à 3,4 cm (Hofmann, 2007)
- Détermination de la chenille
13 mm de longueur (Bellmann, 2006), trapue, verte avec une ligne dorsale vert foncé et sur les flancs une ligne blanchâtre (Carter & Hargreaves, 2015)
Répartition géographique : Très commun en France et en Europe (Lewington & Tolman, 2014 ; Carter & Hargreaves, 2015 ; Martiré et al., 2016 ; Haahtela et al., 2017)
Biotope : Diversité d’habitats de milieux ouverts à semi-ombragés, secs à mésophiles depuis le niveau de la mer jusqu’à 3000 m d’altitude (dunes, friches, prairies, bords de chemin, zones agricoles, jardins en ville,…) (Hofmann, 2007 ; Leraut, 2003 ; Lewington & Tolman, 2014 ; Carter & Hargreaves, 2015 ; Martiré et al., 2016 ; Haahtela et al., 2017)
Cycle biologique :
Polyommatus icarus est une espèce polyvoltine c’est-à-dire qu’elle présente plusieurs générations successives chaque année.
Le voltinisme de cette espèce est lié à l’altitude et la latitude : univoltin, juin/juillet en climat froid dans le nord de l’Europe et en altitude en montagne, bivoltin à trivoltin mai/début octobre dans l’essentiel de l’Europe, trivoltin au niveau de la mer, au sud de l’Europe, aux canaries, il est signalé tous les mois (Lewington & Tolman, 2014 ; Martiré et al., 2016).
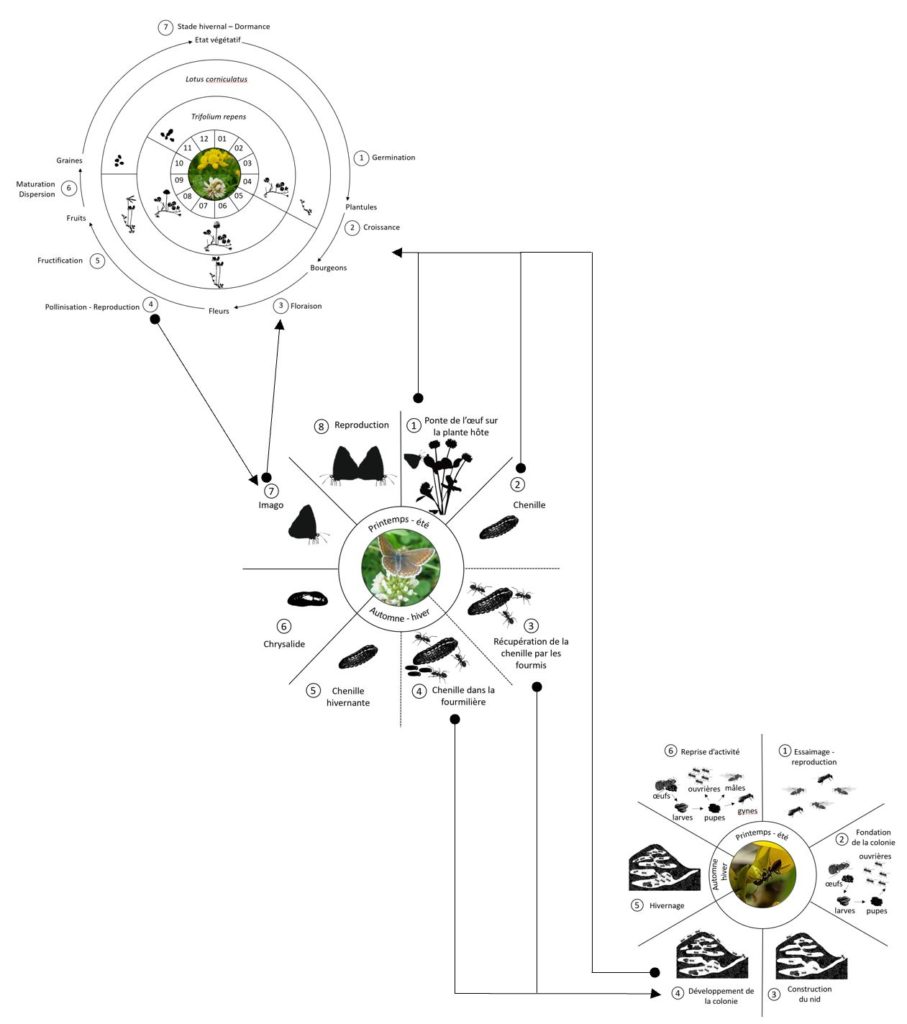
Le cycle biologique de Polyommatus icarus se décompose en 8 étapes comprenant les quatre stades de métamorphose du papillon: œuf, chenille, chrysalide et imago.
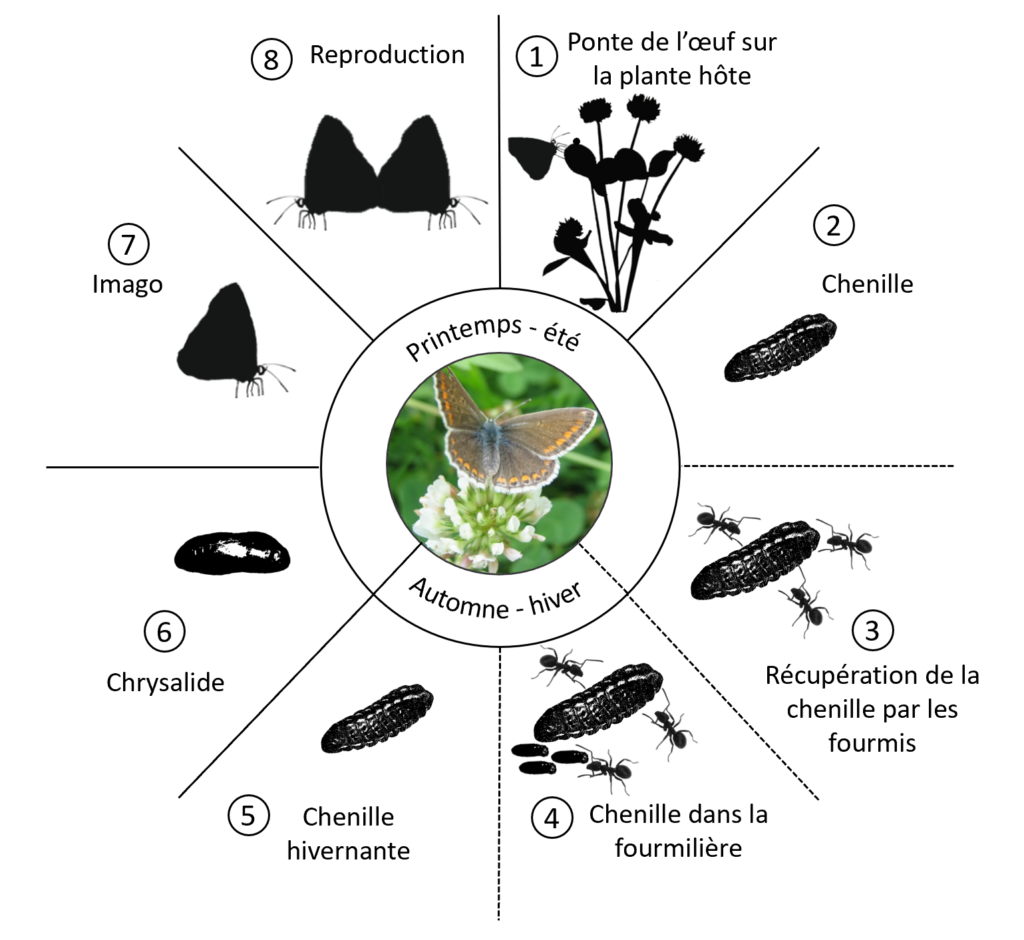
Etape n°1. Ponte de l’œuf sur la plante hôte
La femelle pond des œufs blanchâtres et hémisphériques, disposés isolément les uns des autres, sur les fleurs, les tiges et la face supérieure des feuilles des plantes hôtes au début et à la fin de l’été (Carter & Hargreaves, 2015). Les plantes hôtes sont des légumineuses (Fabaceae) exclusivement des Papillonacées surtout Lotus corniculus (Bellman, 2006; Lewington & Tolman, 2014), Medicago lupulina (Lewington & Tolman, 2014) mais aussi Trifolium repens, Onoris spinosa, Medicago sativa, (Bellman, 2006), et divers galégas (Galega sp.), lotiers (Lotus sp.), luzernes (Medicago sp.), trèfles (Trifolium sp.), mélilots (Melilotus sp.), genêts (Gesnista sp.), astragales (Astragalus sp.), sainfoins (Onobrychis sp.), anthyllides (Anthyllis sp.), coronilles (Coronilla sp.) (Bellman, 2006; Lewington & Tolman, 2014 ; Carter & Hargreaves, 2015 ; Martiré et al., 2016 ; Haahtela et al., 2017).
Etape n°2. Stade chenille
Les œufs éclosent en chenille au bout d’une semaine pendant la période de mai à début octobre (Bellmann, 2006; Carter & Hargreaves, 2015). Durant ce stade qui dure environ 6 semaines (Carter & Hargreaves, 2015), il se produit un accroissement considérable du volume de la chenille ponctué par l’accomplissement de plusieurs mues. Elle se nourrit essentiellement des feuilles et des fleurs des plantes hôtes. La tête de la chenille est fortement sclérifiée avec six yeux simples appelés stemmates ainsi qu’une antenne rudimentaire et au centre des pièces buccales broyeuses. La chenille présente un tronc assez régulièrement constitué de quatorze segments ou urites dont les premiers portent des paires de pattes articulées et les derniers fusionnent pour former un segment anal unique (Bellmann, 2006).
Etape n°3. Récupération de la chenille par les fourmis
Polyommatus icarus est une espèce myrmécophile, c’est-à-dire qu’elle forme une association d’ordre facultatif avec des espèces de fourmis qui vont protéger les chenilles de façon occasionnelle (Pierce et al., 2002). La chenille secrète par la glande nectarifère dorsale de Newcomer un liquide sucré (saccharose, glucose, fructose et acides aminés) apprécié des fourmis et par les glandes verruqueuses une substance inhibant l’agressivité des fourmis (Martiré et al., 2016).
Etape n°4. Chenille dans la fourmilière
Les fourmis emportent ensuite la chenille dans leur fourmilière. La chenille sera protégée des parasites, des prédateurs et soignées par les fourmis de Lasius alienus, Lasius flavus, Lasius niger, Formica subrufa, Formica cinerea, Plagiolepis pygmaea, Myrmica sabuleti, Myrmica lobicornis) (Lafranchis & Kan, 2012; Lewington & Tolman, 2014). Lasius est le genre de fourmi qui s’associe le plus aux lépidoptères Lycaenidae (Martinez, 2013). Dans la fourmilière, la chenille consomme quelques œufs et larves de fourmis. En échange, elle fournit un miellat (un mélange liquide composé de sucres et d’acides aminés) pour les fourmis (Pierce et al., 2002 ; Martiré et al., 2016).
Etape n°5. Chenille hivernante
Les chenilles de la dernière génération hivernent quel que soit leur état d’avancement de croissance dans les sous-bois parmi les feuilles mortes et débris de végétaux (Bellmann, 2006; Carter & Hargreaves, 2015).
Etape 6. Stade chrysalide
Au terme de son développement, la chenille se transforme en chrysalide ou nymphe. La nymphose correspond à de profondes évolutions internes de transformation des tissus larvaires en tissus imaginaux (Bellmann, 2006) et s’effectue au pied de la plante hôte pendant environ deux semaines au printemps-été (Carter & Hargreaves, 2015). Les nymphes présentent des formes et coloris qui leur permettent de se dissimuler des prédateurs parmi les végétaux (Bellmann, 2006).
Etape n°7. Stade imago
L’imago (papillon adulte) sort de la chrysalide au bout de quelques jours. Les chenilles de dernière génération achèvent leur développement en imago au printemps suivant. L’imago dispose d’un corps appelé exosquelette composé d’une tête avec des yeux, des antennes (organes olfactifs et tactiles) et d’une trompe maxillaire permettant d’aspirer le nectar de plusieurs espèces végétales de Papilionacées; d’un thorax avec six pattes, quatre ailes membraneuses recouvertes d’écailles; et d’un abdomen avec les organes reproducteurs et les organes odoriférants qui produisent les phéromones (Bellmann, 2006).
Etape n°8. Reproduction
Les imagos volent entre fin mars et novembre (Hofmann, 2007 ; Carter & Hargreaves, 2015 ; Haahtela et al., 2017). Pendant cette période, les adultes se rencontrent grâce aux phéromones (substances d’attraction sexuelle) secrétées par les femelles non fécondées et les organes olfactifs des mâles. Les mâles captent les phéromones sur des kilomètres et sécrètent à leur tour des phéromones afin de s’accoupler. Polyommatus icarus se caractérise par la grande fertilité des femelles (Bellmann, 2006). Les imagos vivent quelques semaines à quelques mois.
A chaque stade du cycle de vie, les papillons sont exposés à divers prédateurs : mammifères, oiseaux insectivores (exemple mésanges), amphibiens, araignées (exemple les araignées-crabes), les insectes (exemple les guêpes, les frelons) (Bellmann, 2006).
Biologie et écologie de la Fourmi noire des jardins Lasius niger (Linnaeus, 1758) (Hymenoptera, Formicidae)
Nom latin : Lasius niger (Linnaeus, 1758)
Noms vernaculaires : Fourmi noire des jardins ; Small Black Ant (Anglais)
Taxonomie : Règne : Animalia, Embranchement: Arthropoda, Classe : Insecta, Ordre : Hymenoptera, Famille : Formicidae, Genre : Lasius, Espèce : Lasius niger
Détermination de l’espèce
Couleur brun foncé à brun-noir, couverte de soies argentées assez denses parsemés de soies isolées plus longues, pubescence sur le clypeus (Blatrix et al., 2013 ; Bellmann, 2016)
Les fourmis sont des insectes sociaux organisés en castes: Reine femelle fertile mesurant de 8 à 9 mm ; Mâles dont la seule fonction est de féconder les futures reines 3,5-4,5 mm ; Ouvrières femelles stériles 2,5-5 mm (Blatrix et al., 2013 ; Martinez, 2013; Bellmann, 2016)

Répartition géographique : très commune en Europe sauf en région méditerranéenne (Blatrix et al., 2013 ; Bellmann, 2016)
Biotope : Diversité d’habitats plutôt humides jusqu’à 1500 m d’altitude (prairies, lisières de forêts, divers milieux anthropisés, zones agricoles, jardins en ville,…) (Blatrix et al., 2013 ; Bellmann, 2016)
Cycle biologique de la colonie de Lasius niger
Lasius niger est une espèce monogyne, c’est-à-dire que la colonie ne possède qu’une seule reine. La colonie est constituée également de milliers d’ouvrières (Blatrix et al., 2013). Le cycle biologique de la colonie de Lasius niger se décompose en 5 étapes comprenant les quatre stades de développement de la fourmi : œuf, larve, nymphe, adulte (reines, mâles, ouvrières).

Etape n°1. Essaimage – Reproduction
L’essaimage est la période de vol nuptial des mâles et femelles sexués (princesses) qui se reproduisent de juin à septembre. Les essaimages sont abondants dans la deuxième quinzaine de juin. Les femelles sont fécondées par les mâles et stockent les spermatozoïdes pour le restant de leur vie. Ces femelles devenues reines arrachent ensuite leurs ailes et cherchent un endroit sombre, humide et calme pour commencer la fondation d’une nouvelle colonie (Martinez, 2013; Bellmann, 2016). La reine a une durée de vie d’environ 20 ans avec un record de 28 ans en captivité (Martinez, 2013). Après l’accouplement, les mâles meurent rapidement.
Etape n°2. Fondation de la colonie
La reine pond des premiers œufs qui éclosent au bout d’une dizaine de jours. Ces premières larves sont nourries par la reine par trophallaxie c’est-à-dire par régurgitation de la nourriture pré-digérée. L’aliment trophallactique provient des réserves corporelles de la reine en métabolisant ses réserves de graisse et les muscles de ses ailes. Les larves velues facilitant leur transport tissent ensuite un cocon au support où elles se trouvent et deviennent après quelques dizaines de jours de mues des nymphes. Les nymphes ne s’alimentent pas. En septembre, les nymphes donnent des premières ouvrières très petites et blanches qui deviennent rapidement foncées (Matinez, 2013). Ces premières ouvrières sortent du nid pour chercher de la nourriture (miellat des pucerons, insectes morts et nectar des plantes, Martinez, 2013) pour nourrir par trophallaxie la reine et reprennent le relais de la fondation de la colonie. La reine se consacre ainsi ensuite exclusivement à sa fonction de reproductrice.
Etape n°3. Construction du nid
Les nids sont construits dans la terre, sous les pierres, ou sous l’écorce des arbres débouchant à la surface avec un simple trou et constitués d’un petit dôme de terre et de particules minérales fragile creusé de nombreuses galeries. Les nids peuvent être également trouvés en milieu urbain sous les pierres, les pots de fleurs, entre les dalles de trottoir (Bellmann, 2016). Leur nid peut avoir un aspect assez variable avec généralement des galeries allongées. Les conditions environnementales nécessaires pour le nid sont les suivantes : humidité permanente non excessive, endroit pas trop chaud, aéré, calme et obscure. Si l’humidité est trop faible la reine, les œufs et larves peuvent séchés et mourir. Au contraire, un excès d’eau dans les galeries peut entraîner la mort par noyade des fourmis (Martinez, 2013).
Etape n°4. Développement de la colonie
Les jeunes colonies passent leur temps dans leur nid. La colonie qui aura le plus d’ouvrières survivra. Après sa fondation, la colonie de développe à un rythme accéléré : à la fin du premier automne quelques dizaines, à la fin du deuxième quelques centaines et à la fin du troisième des milliers (Martinez, 2013). Les ouvrières les plus âgées et les plus grandes cherchent la nourriture au sol et sur les plantes pour la colonie. Le régime alimentaire de cette espèce est omnivore (Blatrix et al., 2013; Martinez, 2013). Cette espèce recherche le miellat de pucerons sur les arbres, les arbustes et les herbacées (Blatrix et al., 2013 ; Bellmann, 2016). Elle protège ainsi les colonies de pucerons et de cochenilles (Blatrix et al., 2013). Les ouvrières les plus jeunes sont en charge de l’entretien des œufs, le nourrissage des larves et le nettoyage de la colonie. Les ouvrières ont une durée de vie de 1 à 3 ans (Martinez, 2013).
Etape n°5. Hivernage
Lasius niger est une espèce hétérodynamique endogène c’est-à-dire qu’elle possède un stade obligatoire de dormance ou diapause hivernale obligatoire dans son cycle. L’arrêt des pontes, de la croissance du couvain et de l’activité de la colonie s’effectue selon l’horloge interne de la colonie environ de mi-octobre à mars. A ce stade, il n’y a plus d’œufs, les larves hivernent et nymphoseront le printemps suivant (Martinez, 2013).
Etape n°6. Reprise de l’activité
Au printemps suivant, la reine reprend son activité de ponte. Les œufs de teinte blanc et de forme ellipsoïde se développent en larve d’aspect vermiforme avec un corps effilé et arqué vers l’avant (Bellmann, 2016). Les larves se transforment ensuite en nymphe. Ce stade est défini par de profondes transformations internes : tube digestif, système nerveux, organes des sens, appareil respiratoire, musculature. Les nymphes donnent : des mâles pour les œufs non fécondés ; des femelles pour les œufs fécondés qui seront soit des futures reines ou des ouvrières stériles selon le type de nourriture qu’elles auront reçu à l’état larvaire (Martinez, 2013).
A chaque stade du cycle de vie, les fourmis sont exposées à divers prédateurs : oiseaux, lézards, insectes, araignées et d’autres fourmis.
Biologie et écologie des plantes hôtes du papillon Polyommatus icarus : Lotus corniculatus (Linné, 1753), Trifolium repens (Linné, 1753) (Fabale, Fabaceae)
Nom latin :
- Lotus corniculatus (Linné, 1753)
- Trifolium repens (Linné, 1753)
Noms vernaculaires :
- Lotier corniculé, Pied de poule, Sabot-de-la-mariée, Common Bird’s-foot-trefoil (Anglais)
- Trèfle rampant, Trèfle blanc, Trèfle de Hollande, White Clover (Anglais)
Taxonomie : Règne : Plantae, Classe : Equisetopsida, Ordre : Fabales, Famille : Fabaceae (Famille anciennement appelée légumineuses), Genre : Trifolium, Lotus, Sous-Famille : Papilionoideae, Espèce : Lotus corniculatus, Trifolium repens
Détermination des espèces
Plantes vivaces, rampantes de 5 à 50 cm de hauteur (Bellmann, 2006 ; Mac Clintock et al., 2005 ; Fletcher et Eyssartier, 2008)
1) Lotus corniculatus
Plante de 5 à 30 cm de hauteur ; Racine longue et pivotante ; Tige peu ramifiée ; Feuilles composées de 5 folioles ovoïdes à lancéolées, brièvement pétiolées ; Fleurs de 1 à 1,6 cm, de couleur jaune éclatant, souvent lavées de rouge à l’extérieur, regroupées par 2 à 7 en capitule ombelliforme, floraison de mai à septembre ; Pédoncule floral plus long que les feuilles ; Fruits en gousses linéaires de 2 à 3 cm de longueur, un peu épaisses de 4 mm (Bellmann, 2006 ; Mac Clintock et al., 2005 ; Fletcher et Eyssartier, 2008)

2) Trifolium repens
Plante de 5 à 20 cm de hauteur ; Tige glabre, rameuse, atteignant 50 cm de longueur ; Feuilles alternes, plus ou moins longuement pétiolées, pétiole atteignant 20 cm de longueur, trifoliées ; Folioles supérieures à 10 mm de long ovales, denticulées sur le bord, pourvues d’un motif blanc en forme de chevron ; Fleurs blanches ou rosées de 7 à 10 mm au nombre de 20 à 100 fleurs par inflorescence, groupées en capitules de 25 mm de diamètre, floraison de mai à octobre ; Pédoncule floral pouvant dépasser 30 cm de longueur ; Fruits en gousses sessiles de 3 à 4 graines en forme de cœur, de couleur jaune à brune et mesure environ 1.6 mm par 1mm avec un poids moyen de 0.66g (Bellmann, 2006 ; Laberche, 1999; Mac Clintock et al., 2005 ; Fletcher et Eyssartier, 2008)

Répartition géographique
Espèce largement répandue et très communes en France et en Europe (Bellmann, 2006 ; Mac Clintock et al., 2005 ; Fletcher et Eyssartier, 2008) presque partout et pour Lotus corniculatus jusqu’à près de 3000 m d’altitude en montagne (Bellmann, 2006 ; Fletcher et Eyssartier, 2008)
Biotope
Zones herbeuses, friches, champs, pâtures, pelouses, broussailles de bord de chemin et de route, gazons urbains (Bellmann, 2006 ; Mac Clintock et al., 2005 ; Fletcher et Eyssartier, 2008)
Cycle biologique
Les étapes du cycle de vie des plantes à fleurs en dehors de la multiplication végétative sont les suivantes : germination, croissance de l’appareil végétatif, floraison, pollinisation, fructification, dispersion et le stade de dormance. Les plantes étudiées sont des espèces vivaces ou pérennes, c’est-à-dire que leur cycle de vie est étalé sur plusieurs années supérieurs à deux ans (Laberche, 1999). Ce sont également des espèces de la famille des légumineuses qui regroupe une importante variété d’espèces végétales cultivées.
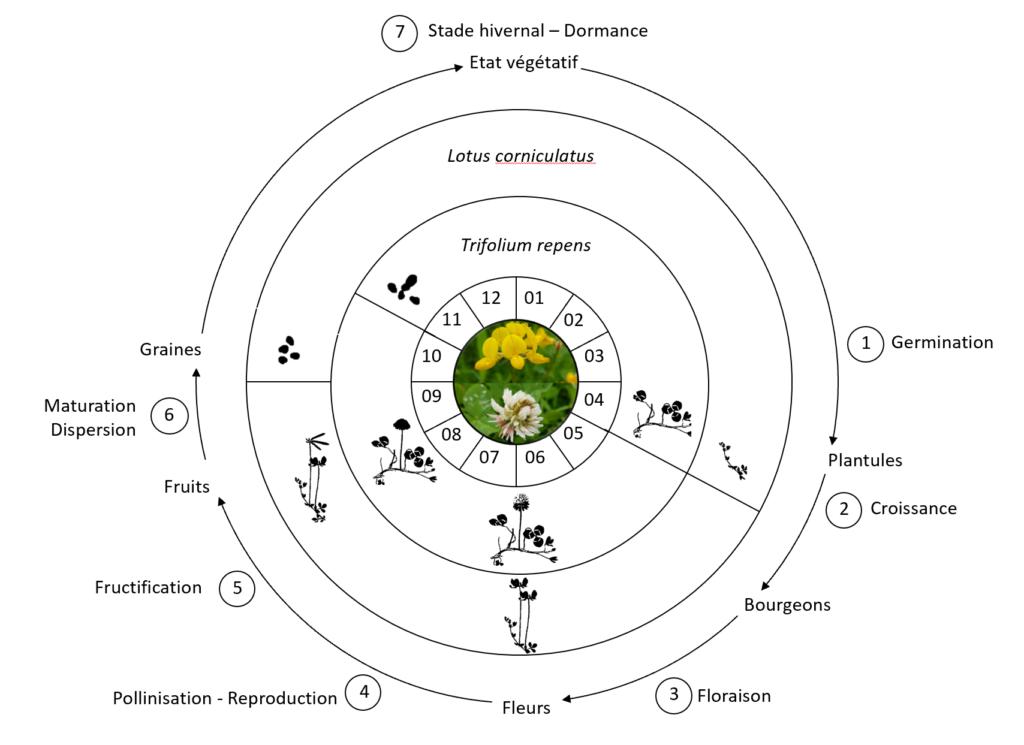
Etape n°1. Germination
La graine est une partie du fruit qui contient l’embryon avec les organes végétatifs de la jeune plante, c’est-à-dire la radicule qui donnera la racine, la tigelle future la tige et la gemmule ébauche du bourgeon terminal (Heller et al.,1995).
La graine passe de la vie latente à la germination si les conditions favorables externes et internes sont favorables : eau, oxygène, température, luminosité, durée du jour ; graine mûre avec accumulation des réserves et déshydratée, longévité des semences. La germination se traduit par la sortie du germe qui perce les téguments de la graine. Le début de la croissance de la future plantule est rendu possible par l’utilisation des réserves nutritives contenues dans la graine (Heller et al.,1995 ; Laberche, 1999 ; Ozenda, 2000). La germination se termine en quelques jours lorsque toutes les réserves de la graine ont été consommées et que la photosynthèse a pris le relais pour assurer l’approvisionnement de la plantule devenue autonome (Heller et al.,1995).
Etape n°2. Croissance de l’appareil végétatif
Le développement de la plantule en plante adulte se caractérise par la croissance des racines, l’allongement de la tige et l’accroissement du nombre de feuilles (Heller et al.,1995). Contrairement à la majorité des espèces animales, les plantes ont une croissance indéfinie pendant leur cycle de vie. Les plantes vivaces ont la particularité d’avoir une croissance discontinue. La naissance de nouvelles tiges et de nouveaux rameaux feuillés est réalisée chaque année par l’éclosion des bourgeons. Les bourgeons sont des mamelons situés à l’apex des tiges et des rameaux ou à l’aisselle des feuilles. Les bourgeons végétatifs assurent le développement des tiges, rameaux végétatifs, et feuilles et les bourgeons floraux les rameaux florifères et des fleurs (Heller et al.,1995 ; Ozenda, 2000). Pour réaliser cette croissance, les plantes ont besoin d’eau, de sels minéraux absorbés par les racines et d’anhydride carbonique par le processus de photosynthèse (Laberche, 1999).
Etape n°3. Floraison
La floraison est un phénomène complexe lié à de nombreux facteurs internes et externes. Les fleurs se forment dans les bourgeons qui passent de l’état végétatif à l’état reproducteur. La floraison est synchronisée avec les saisons. Chaque espèce végétale forme ses fleurs à un moment particulier de l’année déterminé par les conditions climatiques (température, éclairement et précipitations) (Heller et al.,1995). Chez les plantes vivaces, la très grande majorité des espèces fleurissent tous les ans (Laberche, 1999). L’épanouissement de la fleur s’accompagne de la déhiscence des anthères c’est-à-dire la rupture des parois des sacs polliniques et la libération du pollen (Heller et al.,1995).
Etape n°4. Pollinisation – reproduction
La fleur est constituée d’étamine organe de fécondation mâle et du pistil organe de fécondation femelle. Lors de la phase de la pollinisation, les grains de pollen produit par les étamines sont transportés en état de vie latente par différents vecteurs (le vent anémogamie, l’eau hydrogamie, animaux zoogamie) jusqu’au pistil d’une autre plante contenant l’ovule enclos dans un ovaire. Chez les espèces végétales étudiées, les insectes pollinisateurs comme par exemple les papillons sont des vecteurs de transport des grains de pollen. La pollinisation est dite entomophile. Les papillons en se nourrissant du nectar transportent de plante en plante le pollen qui s’accroche à leur corps. Si le grain de pollen au cours de son transport rencontre le stigmate d’un ovaire et s’il y a compatibilité génétique entre les deux organes et que les conditions sont favorables (humidité, température, ensoleillement) alors le processus de fécondation s’engage. Le grain de pollen s’hydrate et sort de sa vie latente et germe en un tube pollinique qui atteint le sac embryonnaire permettant la fécondation. Les Angiospermes sont caractérisées par une double fécondation. L’œuf diploïde donnera le nouvel embryon, l’autre triploïde formera des substances de réserves nécessaires à la germination (Heller et al.,1995 ; Laberche, 1999 ; Ozenda, 2000).
Etape n°5. Fructification
Lors de la fructification, la fleur se fane et l’ovule fécondée se transforme en graine et l’ovaire en fruit (Heller et al.,1995 ; Laberche, 1999 ; Ozenda, 2000). Les légumineuses ont des fruits secs comestibles contenus dans des gousses (Heller et al.,1995 ; Ozenda, 2000). Les étapes de la formation et la vie du fruit sont les suivantes : un stade pré-anthèse correspondant à une multiplication cellulaire, l’anthèse caractérisée par l’arrêt de la croissance des tissus, une période de croissance et enfin la maturation suivie par la sénescence du fruit (Heller et al.,1995).
Etape n°6. Maturation – Dispersion
Après quelques semaines ou mois, le fruit mûrit libérant des graines. Chez Trifolium repens, 3 à 4 semaines sont nécessaires entre la fécondation et la formation de la graine. Les modes de dissémination des graines sont les suivants : la plante elle-même (autochorie), le vent (anémochorie), l’eau (hydrochorie), les animaux (zoochorie). Les légumineuses utilisent le mécanisme de dispersion par la plante appelée l’autochorie. Les gousses sont des fruits dits secs déhiscents, c’est-à-dire s’ouvrant à maturité par des fentes pour libérer des graines (Ozenda, 2000). Les graines en contact avec le sol pourront ensuite germer pour former de nouvelles plantes (Heller et al.,1995 ; Laberche, 1999 ; Ozenda, 2000).
Etape n°7. Stade hivernal dormance – état végétatif
Les plantes vivaces passent l’hiver en vie ralentie sous forme d’organes de réserve souterrains munis de quelques feuilles. Trifolium repens survit par sa souche enterrée (Laberche, 1999). Les graines qui n’ont pas germé entre également en dormance en saison hivernale. La vie latente correspond aux activités cellulaires réduites permettent aux plantes de résister aux conditions défavorables. La respiration et le dégagement de chaleur sont réduites. Les échanges nutritifs, la synthèse et la croissance sont arrêtés. La partie supérieure des espèces végétales vivaces se renouvelle ensuite tous les ans et produit de nouvelles graines durant plusieurs années. Les graines en dormance reprennent une vie active et germent l’année suivante lorsque les conditions extérieures sont favorables (Heller et al.,1995 ; Laberche, 1999).
Relations entre les cycles biologiques de Polyommatus icarus avec Lasius niger, Lotus corniculatus et Trifolium repens
Le cycle biologique de Polyommatus icarus est dépendant du cycle biologique de ses plantes hôtes dont Lotus corniculatus et Trifolium repens. La ponte de l’œuf de P. icarus (stade n°1 P. icarus) est réalisée sur les plantes hôtes adultes (à la fin de leur croissance stade n°2 plantes hôtes). L’œuf éclot en chenille (stade n°2 P. icarus) dont la survie est assurée exclusivement sur ses plantes hôtes dont elle se nourrira. Suite au développement de la chenille en chrysalide puis en imago (stade n°6 et 7 P. icarus), ces plantes nectarifères (stade n°3 plantes hôtes) sont également une source de nourriture importante pour les papillons adultes qui pourront se reproduire (stade n°8 P. icarus). En allant de fleurs en fleurs, les papillons pollinisent ses plantes hôtes qui pourront à leur tour se reproduire (stade n°4 des plantes hôtes).
Une association facultative peut être réalisée entre Polyommatus icarus et des espèces de fourmis dont Lasius niger. Au stade n°2 du cycle biologique de P. icarus, la chenille attire les fourmis qui vont l’amener dans le nid (stade n°3 P. icarus) et la protéger des parasites, des prédateurs et la soigner (stade n°4 P. icarus). Dans la fourmilière, la chenille consomme quelques œufs et larves de fourmis. En échange, elle fournit une source de nourriture contribuant au développement de la colonie des fourmis (stade n°4 L. niger). Les fourmis se nourrissent du miellat des pucerons qui se trouvent notamment sur les plantes hôtes de P. icarus.